Литий: Свойства и применение элемента
Понимание лития как элемента
Что такое литий?
Литий, атомный номер 3 и символ Li, - самый легкий металл в периодической таблице и щелочной металл. За два века своего существования в качестве лабораторной диковинки литий превратился в промышленный товар, продаваемый по всему миру. Сегодня рафинирование и производство лития - путем электролиза соли или измельчения минералов, таких как сподумен, - является основой многомиллиардной индустрии в области хранения энергии, освоения космоса и электроники.

Описание химических свойств
Химические свойствалития являются зеркальным отражением его физических свойств:
-Реактивность: Литий бурно реагирует с водой, образуя гидроксид лития (LiOH) и газообразный водород. Например, маленький кусочек лития, погруженный в воду, может за считанные секунды вызвать видимое шипение.
-Щелочная природа: Будучи еще одним щелочным металлом, литий легко отдает свой внешний электрон, образуя ион Li⁺, и таким образом становится важным участником электрохимических реакций, в том числе в литий-ионных батареях.
- Воспламеняемость: Литий воспламеняется с характерным красным пламенем, что необходимо учитывать инженерам при работе с литием и его хранении.
Таблица данных физических свойств
|
Свойство |
Значение |
|
Атомный номер |
3 |
|
Атомный вес |
6,94 г/моль |
|
Температура плавления |
180.54 °C |
|
Температура кипения |
1590 °C |
|
Плотность |
0,534 г/см³ |
|
Внешний вид |
Серебристо-белый металл |
|
Твердость |
Мягкий |
|
Электропроводность |
Высокая |
|
Теплопроводность |
Высокая |
Открытие лития
Впервые литий был обнаружен в 1817 году в петалите, на острове Утё, Швеция. Анализ Арфведсона выявил новый неопознанный элемент со свойствами, отличными от свойств натрия или калия. Позднее металлический литий был выделен путем электролиза литиевых солей, чтобы ученые и инженеры могли продолжить анализ его физических и химических свойств. Со временем странное сочетание легкости, высокой реакционной способности и электрохимического потенциала лития вывело его на траекторию развития - от хранения энергии до промышленных смазок и медицины.
Сплавы и соединения лития
- Литий-алюминиевые сплавы: Чрезвычайно легкие и твердые, используются в компонентах самолетов и деталях спортивных автомобилей.
- Литий-медные сплавы: Придают повышенную электропроводность, часто используются в электронных разъемах и схемах.
- Литий-железо-фосфат (LiFePO₄): Распространен в катодах аккумуляторов электромобилей благодаря стабильности и длительному сроку службы.
- Гидроксид (LiOH) и карбонат (Li₂CO₃) лития: Имеют ключевое значение для перезарядки аккумуляторов, смазочных материалов и промышленных химических процессов.
- Хлорид лития (LiCl): Используется в осушителях, кондиционерах и химическом синтезе.
Например, Tesla и другие производители электромобилей используют литий-железо-фосфатные (LFP) батареи в некоторых автомобильных парках, где термическая стабильность и плотность энергии имеют первостепенное значение для обеспечения безопасности и функциональности.
Распространенные области применения
Существуют различные области применения лития:
1. Аккумуляторы: Литий-ионные и литий-полимерные батареи доминируют на рынке портативной электроники, электромобилей и систем хранения возобновляемой энергии благодаря своей высокой плотности энергии.
2. Сплавы: Литий облегчает алюминиевые и медные сплавы, повышая эффективность аэрокосмической техники без потери прочности.
3. Использование в медицине: Карбонат лития стабилизирует состояние пациентов с биполярным расстройством, демонстрируя влияние лития не только в промышленности.
4. Термостойкое стекло и керамика: Литий повышает устойчивость к тепловым ударам и прочность.
5. Смазочные материалы: Литиевые смазки обладают хорошими эксплуатационными характеристиками при высоких температурах и давлениях, что очень важно в обрабатывающей промышленности и автомобилестроении.
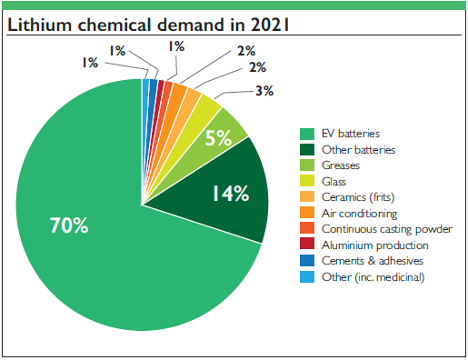 [1]
[1]
Процессы получения
Литий в основном получают путем:
1. Металлический литий извлекают из LiCl или LiF путем электролиза, чтобы получить высокочистый металл для применения на рынке.
2. Добыча минералов: Сподумен и петалит перерабатываются в карбонат или гидроксид лития для использования в производстве аккумуляторов и химических веществ.
Часто задаваемые вопросы
В каких областях чаще всего используется литий?
В первую очередь в аккумуляторных батареях, легких сплавах, смазочных материалах и фармацевтических препаратах.
Как добывается литий?
Путем электролиза литиевых солей или из сподуменовых руд.
Реактивен ли литий?
Да, особенно с водой, с образованием LiOH и газообразного водорода.
Что такое литий-ионные аккумуляторы?
Они обеспечивают питание смартфонов, ноутбуков, электромобилей и систем хранения возобновляемой энергии благодаря высокой плотности энергии и длительному сроку службы.
Ссылки:
[1] Международная литиевая ассоциация (2023, 13 октября). Литий 101. Retrieved July 17, 2025, from https://lithium.org/lithium-101/.

 Бары
Бары
 Бисер и шары
Бисер и шары
 Болты и гайки
Болты и гайки
 Кристаллы
Кристаллы
 Диски
Диски
 Волокна и ткани
Волокна и ткани
 Фильмы
Фильмы
 Хлопья
Хлопья
 Пены
Пены
 Фольга
Фольга
 Гранулы
Гранулы
 Медовые соты
Медовые соты
 Чернила
Чернила
 Ламинат
Ламинат
 Шишки
Шишки
 Сетки
Сетки
 Металлизированная пленка
Металлизированная пленка
 Тарелка
Тарелка
 Порошки
Порошки
 Род
Род
 Простыни
Простыни
 Одиночные кристаллы
Одиночные кристаллы
 Мишень для напыления
Мишень для напыления
 Трубки
Трубки
 Стиральная машина
Стиральная машина
 Провода
Провода
 Конвертеры и калькуляторы
Конвертеры и калькуляторы
 Пишите для нас
Пишите для нас




 Chin Trento
Chin Trento



