Применение ванадия и его использование в зависимости от степени окисления
Это содержание взято из стипендии колледжа Stanford Advanced Materials 2025 года, предоставленной Эддисоном Бойлом.
Введение
Ванадий относится к переходным металлам; его атомный номер - 23. Его содержание в земной коре составляет около (0,02%), как и цинка.1 Несмотря на его обилие, он не привлекал особого внимания до последних 50 лет. Исследования показали, что ванадий может иметь биологическое назначение благодаря ванадат-иону.2 Существует как минимум 6 различных состояний окисления; ванадий в основном существует в +3, +4 и +5. В изолированном состоянии каждое из состояний окисления имеет свой цвет. V4+ - синий, V3+ - зеленый, а V2+ - фиолетовый.3 Эти степени окисления также наиболее важны для биологических систем.4
Ванадий в крови:
Эти состояния окисления ванадия важны, поскольку они могут вступать в окислительно-восстановительные реакции.4 Стабильность зависит от лигирования, растворителя и рН.2 Биогенетически это означает, что существуют восстановители, которые могут переводить ванадий в более низкие состояния окисления.4 Этот процесс зависит от рН, при повышении рН окислительно-восстановительные потенциалы снижаются.4 При приеме лекарственных препаратов они поступают в кровь и входят в состав сыворотки крови.4 Реакция с ванадием определяет его видовую принадлежность.1
В слабокислых условиях V(III), образуясь, напоминает существующие биологические системы.1 В плазме крови могут присутствовать восстановители, которые могут привести к стабилизации V(III), позволяя образовываться видам V(III)2-hTF.1 Этивиды напоминают Fe(III) 2-hTF, который распознается клеточными рецепторами.1 Это может происходить, когда V(III) или Fe(III) притягиваются к ГТФ, если в плазме крови имеется V(IV)O, тогда восстановление до V(III) может быть благоприятным с точки зрения выигрыша энергии.1 Связывание V(III) имеет logK 20, в то время как если V(IV)O+2 имеет logK 13.1 Эта реакция должна проходить в слабокислых условиях.1
Было замечено, что другие состояния окисления ванадия (V(IV) и V(V)) могут подвергаться обмену лигандов и окислительно-восстановительному взаимопревращению.1 Лигандами с низкой молекулярной массой являются лактат и цитрат, а с высокой молекулярной массой - ГТФ, альбумин и иммуноглобулин G.1 Как и в случае V(III), V(IV) и V(V) хорошо реагируют из-за остатков Fe(III), связывающих hTF.1 Поскольку Fe(III) 2-hFT распознается клеточными рецепторами для эндоцитоза.1 Это может быть возможно и для комплексов V(IV) и V(V).1 При инкубации V(IV)OSO4 и апо-ГТФ показано, что они соответствуют ГТФ.1 Также показано, что коэффициент образования ниже, чем у Fe(III) 2hTF.1Было показано, что комплексы VIVO и VIVO-носитель, наряду с V(V) в виде монованадата, могут связываться с holo-hTF, который является транспортным агентом в крови.1 Это означает, что ванадий может присутствовать в плазме крови и проходить через эндоцитоз, когда holo-входит в клетки.1
Ванадат:
Существует 3 основных типа реакций, которые могут быть осуществлены с ванадатом в водной химии: реакции самоконденсации, координационные реакции и окислительно-восстановительные реакции.4
Для реакций конденсации анионы ванадата протонируются олигомерами в слабокислой среде, чтобы сделать ее более благоприятной.4 Это очень важно для функционирования клеток, поскольку рН влияет на различные органеллы.4 В опухолевых клетках было показано, что у них повышен рН органелл.4 Это может означать, что ванадат может быть использован для поиска опухолевых клеток с повышенным рН.4 Это может быть сделано с помощью серии олигомеров ванадата в кислой среде.4
Поскольку ванадат имеет сходство с фосфатом, ванадат начали использовать в реакциях координации, но они все еще находятся в основном на стадии пробирки, что означает, что большинство реакций координации являются теоретическими.4 Фосфат важен для биологических систем и участвует во многих биологических распознающих и биокаталитических системах.1 Где VO43- имеет структурное и электронное сходство с PO43- Рис. 1.4 Ванадатные комплексы имеют 5-координатную тригонально-бипирамидальную геометрию, соответствующую 5-координатным переходным состояниям, которые, как предполагается, образуются в реакциях фосфат-зависимых ферментов Рис. 1.1 Хотя могут быть моно- и полидентатные лиганды, в основном используются ванадатные эфиры и ванадатные ангидриды из-за их аналогии с фосфатом. 4 При компьютерном моделировании большая часть ванадата находилась в форме H2VO4- и HVO42- без учета белков, а при включении белков большая часть ванадия была связана с трансферрином.4 Когда металлический комплекс ванадата стабилизирован лигандами, это увеличивает вероятность восстановления.4 Это приводит к координационным реакциям, склонным к восстановлению в биологических системах.4
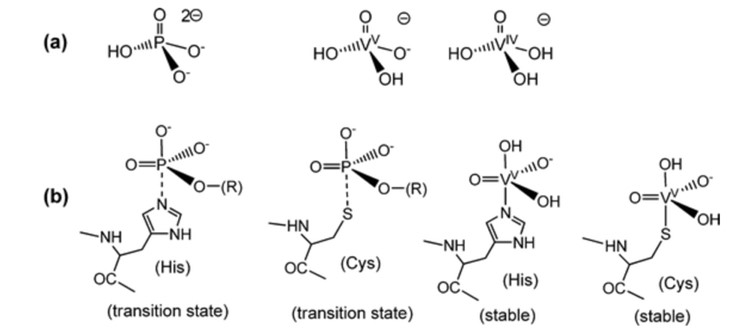
Рис. 1. Сравнение фосфатов и ванадата по переходным состояниям и стабильности.5
В окислительно-восстановительных реакциях в биологических системах состояниями окисления ванадия являются +3, +4 и +5.4 В основном ванадат восстанавливается до V(IV) из V(V).4 Этот тип реакции происходит с различными биомолекулами, особенно в органеллах.4 Он также используется в качестве буфера для фосфотирозильных белков.4 Это приводит к вмешательству в инсулин-сигнальный путь.4 Ванадат может использоваться для лечения диабета, так как после связывания с активным сайтом фермента он не так легко высвобождается, как фосфат.1 Это блокирует сайт от фосфата, что приводит к ингибированию фермента.1 Существуют недостатки использования ванадата для лечения диабета, такие как индуцированный ванадием окислительный стресс, глобальные проблемы токсичности, влияние на иммунную систему и воспаление.1
Исследования рака:
Свойства ванадия были исследованы на предмет его химиопрофилактического и противоопухолевого действия в борьбе с раком.1 Испытания проводились в основном на животных и на линиях злокачественных клеток.1 Дихлорид ванадоцена и несколько пероксованадатов являются основными соединениями ванадия, которые использовались.1 Дихлорид ванадоцена растворим в воде, и при pH 7 хлорид-ионы замещаются на H2O, что приводит к образованию V(C5H5)2]2+.1 Было замечено, что он связывается с ДНК, вызывая иное поведение цисплатина.1 Он также показал ограниченную токсичность, отсутствие перехода через кровяной барьер и не обнаруживается в мозге.1 Мишенями противораковых свойств ванадия являются нарушение клеточного метаболизма, путей передачи сигналов и нарушение клеточной пролиферации.1 Существуют опасения по поводу разнообразных реакций и безопасности ванадия, что привело к отсутствию клинических исследований.1 Учитывая эти опасения, люди продолжают проводить исследования.1 V(V)-mhcpe системы были протестированы in vitro и получили результаты, что они более токсичны для опухолевых клеток, чем для неопухолевых.1 V(IV)-комплексы с производными 1-10-фенантролина в качестве лигандов и V(IV)O-dppz комплексы показали противораковые свойства Рис. 2, особенно против лейкемии.1
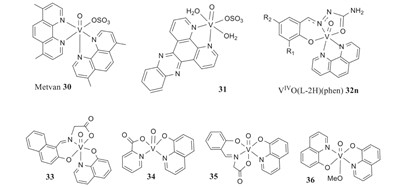
Рис. 2. Изображение противоопухолевых свойств ванадатных соединений с буферной стабильностью pH 7,1
Амавадин:
Существует гриб, накапливающий ванадий, который называется Amanita muscaria, или мухомор.6 Обычный гриб содержит менее 0,5 мг V кг-1, но A. muscaria может содержать 100 мг V кг-1.6 Части тела гриба, содержащие ванадий, - это ножка, кожица шляпки, мякоть шляпки, жабры, споры и луковица.6 Самая высокая концентрация ванадия - в луковице, 1000 мг V кг-1.6 Эта часть гриба расположена в самой нижней части трубки, поэтому она наиболее подвержена загрязнению из почвы.6 При изучении верхнего слоя почвы медиана содержания ванадия составила 60 мг кг-1, а диапазон - от 1,28 до 537 мг кг-1.6 Ванадий, обнаруженный в A. muscaria, был отрицательно заряжен и получил у Байера и Кнайфеля название амавадин Рис 3.6 С помощью спектроскопии электронного парамагнитного резонанса (ЭПР) было обнаружено, что степень окисления ванадия равна +4.6 Спектры ЭПР также показали, что различные части гриба содержат одно и то же соединение амавадин.6 Это 2 тетрадентатных лиганда, показанных на рис. 3, которые могут координироваться с ванадиевым центром, образуя 2 изомера, которые появляются в почти равной смеси в синтетическом и природном амавадине.6
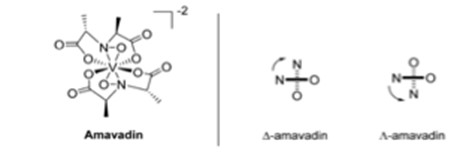
Рис. 3. Структура амавадина с изомерами D и L.6
Окисление V(IV) до V(V) в амавадине обратимо, что означает, что он может обладать каталитическими свойствами.6 Было обнаружено, что комплекс катализирует широкий спектр реакций.6 Это привело к синтезу различных аналогов амавадина с различными ионными центрами металлов или модифицированными лигандами.6 Когда амавадин был синтезирован из A. muscaria, было обнаружено, что существуют различные комплексы ванадия, наиболее заметным из которых является ванадилацетат.6 В твердом веществе было обнаружено 26% (масс./масс.) ванадилацетата и 74% (масс./масс.) амавадина.6
Заключение
В заключение следует отметить, что ванадий находит множество применений в биологических системах. Начиная от лечения рака и заканчивая грибами. В ходе исследований изучались различные состояния окисления и способы их восстановления в биологических системах, например в крови или клетках. Основные степени окисления ванадия - +3, +4 и +5. Лиганды, которые обычно ассоциируются с ванадием, - это кислородные комплексы, особенно ванадат и ванадилацетат. Предстоит еще много исследований, посвященных ванадию и его влиянию на научное сообщество.
Ссылки:
1. Дж. Коста Пессоа, Журнал неорганической биохимии, 2015, 147, 4-24
2. А. Батлер и К. Дж. Каррано, Обзоры по координационной химии, 1991, 109, 61-65
3. D. Rehder, Bioinorganic Vanadium Chemistry, Wiley, Incorporated, New York, 2008.
4. X. Янг и К. Ванг, Прогресс в молекулярной и субклеточной биологии, под ред. W. E. G. Muller, P. Jeanteur, R. E. Rhoads, D. Ugarkovic, and M. R. Custodio. Springer, Manz, Germany, 2013, ch. 1, pp 1-19.
5. Д. Редер, Металломика, 2015, 7, 732
6. С. Брауэр, М. Валента, Л. Штайнер и В. Гесслер, Королевское химическое общество, 2021, 36, 954-967.

 Бары
Бары
 Бисер и шары
Бисер и шары
 Болты и гайки
Болты и гайки
 Кристаллы
Кристаллы
 Диски
Диски
 Волокна и ткани
Волокна и ткани
 Фильмы
Фильмы
 Хлопья
Хлопья
 Пены
Пены
 Фольга
Фольга
 Гранулы
Гранулы
 Медовые соты
Медовые соты
 Чернила
Чернила
 Ламинат
Ламинат
 Шишки
Шишки
 Сетки
Сетки
 Металлизированная пленка
Металлизированная пленка
 Тарелка
Тарелка
 Порошки
Порошки
 Род
Род
 Простыни
Простыни
 Одиночные кристаллы
Одиночные кристаллы
 Мишень для напыления
Мишень для напыления
 Трубки
Трубки
 Стиральная машина
Стиральная машина
 Провода
Провода
 Конвертеры и калькуляторы
Конвертеры и калькуляторы
 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


