Понимание отравления катализаторов из драгоценных металлов: Причины, проблемы и решения
1 Введение
Катализаторы из драгоценных металлов играют важную роль в химической промышленности, энергетике и защите окружающей среды. Благодаря уникальной электронной структуре и свойствам поверхности катализаторы из драгоценных металлов могут эффективно катализировать различные химические реакции. Однако на практике токсичные вещества часто воздействуют на эти катализаторы, что приводит к снижению активности, изменению селективности и даже сокращению срока службы. Чтобы решить эту проблему, в данном блоге мы подробно рассмотрим механизмы и области применения катализаторов из драгоценных металлов, изучим причины и последствия отравления катализаторов, а также предложим меры по повышению их антиотравляющей способности и срока службы.

Рис. 1 Черный порошок платины (Fuel Cell Grade) предоставлен Stanford Advanced Materials
2 Введение в катализаторы из драгоценных металлов
2.1 Механизмы катализаторов из благородных металлов
С точки зрения электронной структуры, благородные металлы (например, платина, палладий, родий, иридий и т. д.) имеют заполненные или почти заполненные d-электронные орбитали. Эти d-электронные орбитали могут эффективно перекрываться с орбиталями молекул реагирующих веществ, обеспечивая необходимую энергию активации, благодаря чему реакция может протекать при более низком энергетическом барьере. Участие d-электронов позволяет благородным металлам образовывать промежуточные соединения с широким спектром реагирующих веществ (например, водородом, кислородом, углеводородами и т. д.) и облегчать процесс реакции. Высокая электронная плотность и равномерность распределения атомов благородных металлов обеспечивают высокую плотность электронного облака на их поверхности. Это помогает катализатору из благородного металла отдавать или принимать электроны в ходе реакции, играя роль хорошего донора или акцептора электронов и способствуя протеканию реакции.
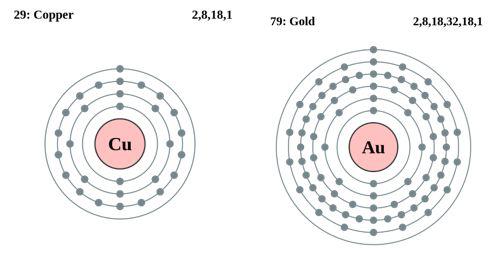
Рис. 2 Периферийное расположение электронов у атомов меди и золота
С точки зрения свойств поверхности, поверхность драгоценного металла обладает сильной адсорбционной способностью, которая может эффективно адсорбировать молекулы реактивов. Эта адсорбционная способность в основном обусловлена сильным взаимодействием между атомами драгоценных металлов и высокой активностью поверхностных атомов. Катализаторы из драгоценных металлов могут взаимодействовать с молекулами реагентов как посредством физической, так и химической адсорбции, обеспечивая активные участки, способствующие протеканию реакции. Поверхности катализаторов из драгоценных металлов также обладают хорошей способностью к восстановлению. В процессе реакции поверхность атомов драгоценных металлов может подвергаться определенной степени реконструкции, чтобы адаптироваться к адсорбции и реакции различных молекул реактивов. Эта способность к перестройке поверхности помогает катализатору сохранять эффективную каталитическую активность в различных условиях реакции.
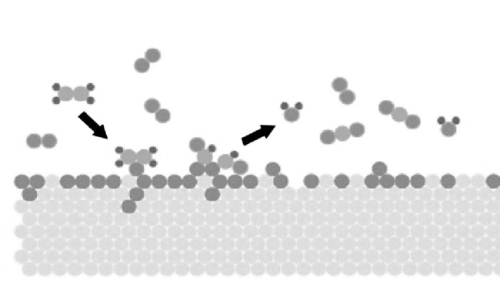
Рис. 3 Схема реакции молекул газа, адсорбированных на поверхности драгоценных металлов
Кроме того, драгоценные металлы обладают высокой термодинамической стабильностью и могут сохранять свою структуру и каталитическую активность при высоких температурах и в жестких химических средах. Это позволяет катализаторам из драгоценных металлов демонстрировать отличную долговечность и стабильность в широком спектре промышленных реакций (например, высокотемпературный крекинг, реакции окисления и т.д.).
Катализаторы из драгоценных металлов способны катализировать множество типов реакций, включая гидрирование, окисление, диспропорционирование, сопряжение и т. д. Такая универсальность обусловлена, прежде всего, обилием поверхностно-активных участков и гибкой электронной структурой, которая позволяет драгоценным металлам адаптироваться к различным механизмам и условиям реакции. Различные виды драгоценных металлов могут также образовывать сплавы с другими металлами для дальнейшего регулирования их электронных структур и свойств поверхности. Например, катализаторы из платино-палладиевых сплавов демонстрируют в некоторых реакциях каталитическую эффективность, превосходящую эффективность отдельных металлов. Легирование может оптимизировать активность, селективность и стабильность катализаторов из драгоценных металлов, тем самым повышая их общую эффективность.
2.2 Области применения катализаторов из драгоценных металлов
Катализаторы из драгоценных металлов используются в газоочистке для защиты окружающей среды благодаря их каталитическому действию на газовые реакции. В тройных катализаторах, обычно используемых для очистки автомобильных выхлопов, в качестве основных компонентов используются платина (Pt), палладий (Pd) и родий (Rh), которые преобразуют монооксид углерода (CO), оксиды азота (NOx) и несгоревшие углеводороды (HC) в автомобильных выхлопах в безвредный диоксид углерода (CO2), азот (N2) и воду (H2O). Платина и палладий также используются в системах очистки выхлопных газов дизельных двигателей для окисления твердых частиц углерода и оксидов азота, выбрасываемых дизельными двигателями. Для очистки выхлопных газов на промышленных химических заводах и нефтеперерабатывающих предприятиях также используются катализаторы из драгоценных металлов, такие как платина и палладий, которые позволяют эффективно удалять вредные компоненты из выхлопных газов. Химические датчики на основе катализаторов из драгоценных металлов используются для обнаружения газообразных загрязнителей, токсичных газов и биомолекул в окружающей среде, например, датчики водорода и формальдегида. Катализаторы на основе драгоценных металлов также используются для деградации загрязняющих веществ, например, для фотокаталитической деградации органических загрязнителей при очистке воды, а композитные катализаторы на основе оксидов платины и титана - для фотокаталитического гидролиза воды с целью получения водорода.
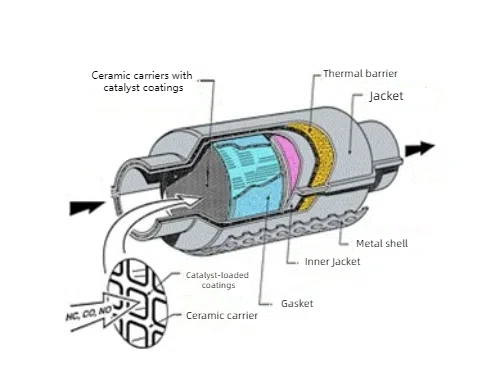
Рис. 4 Структура трехходового каталитического конвертера
В области энергетики катализаторы из драгоценных металлов, особенно платины, используются в электрохимических процессах электролиза воды и окисления метанола в топливных элементах для повышения эффективности преобразования электрической энергии. Платиновые катализаторы в протонообменных мембранных топливных элементах (PEMFC) способствуют электрохимической реакции между водородом и кислородом на электродах для выработки электричества и воды. Катализаторы из сплава платины и рутения в топливных элементах прямого метанола (DMFC) используются для окисления метанола и повышения эффективности топливных элементов. Платиновые электроды также могут использоваться для электролиза воды с целью получения водорода, что повышает эффективность реакции. Катализаторы из драгоценных металлов также используются для преобразования биомассы в химические продукты и топливо с высокой добавленной стоимостью, например, в реакции гидродеоксигенации при производстве биодизеля.
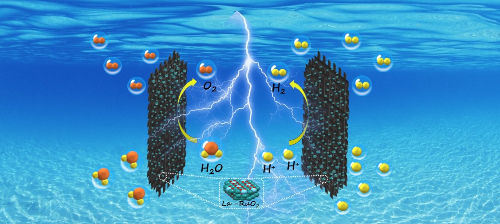
Рис. 5 Получение водорода из кислой электролитической воды, катализируемое La-RuO2 [5].
В химическом производстве катализаторы на основе драгоценных металлов широко используются в органических реакциях. В нефтеперерабатывающей промышленности платиновые и палладиевые катализаторы могут использоваться в процессе гидродесульфуризации для удаления сульфидов из сырой нефти, что позволяет улучшить качество топлива. В процессе риформинга нефти платиновые катализаторы также помогают в производстве высокооктанового бензина и ароматических соединений. В промышленности органического синтеза платиновые и палладиевые катализаторы широко используются для катализа реакций гидрирования, значительно повышая эффективность процесса гидрирования двойных и тройных связей различных органических соединений. Палладиевые катализаторы также могут катализировать реакцию соединения Сузуки и реакцию Хека, которые играют важную роль в синтезе лекарств и построении сложных органических молекул. В области синтеза лекарств катализаторы из благородных металлов часто используются для химических превращений на ключевых стадиях, например, катализируемые палладием реакции кросс-сочетания, которые играют незаменимую роль в синтезе сложных лекарственных молекул. Платиновые и палладиевые катализаторы также широко используются в хиральном катализе, катализируя асимметричные реакции гидрирования для получения хиральных промежуточных продуктов лекарств, обеспечивая оптическую чистоту и биологическую активность препаратов. Катализаторы из драгоценных металлов находят широкое применение при получении наноматериалов, например, платиновые и золотые катализаторы используются для получения высокоэффективных наноматериалов для использования в электронных и оптоэлектронных устройствах.
3 Отравление катализаторами
3.1 Определение отравления катализаторами
Отравление катализатора - это потеря или значительное снижение каталитической активности катализатора в ходе химической реакции из-за присутствия определенных веществ (известных как яды или отравляющие вещества). Эти яды сильно хемосорбируются или реагируют с активными участками катализатора, тем самым препятствуя его нормальному контакту и реакции с реактивами. Отравление катализатора - это неблагоприятное явление, которое приводит к снижению эффективности химической реакции или даже к ее полному прекращению.
3.2 Причины и типы отравления катализатора
Существует три основных механизма отравления катализатора.
1. Химическая адсорбция: Сильная химическая адсорбция молекул яда на активных участках катализатора, так что эти участки не могут продолжать реакцию с реагентами.
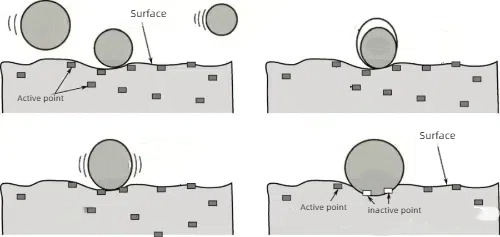
Рис. 6 Схематический принцип хемосорбции
2. Химическая реакция: Токсикант реагирует с активными компонентами катализатора, образуя неактивные соединения, которые покрывают поверхность катализатора.
3. Физическая блокировка: Некоторые яды образуют отложения на поверхности катализатора, физически блокируя поры или активные участки катализатора.
Деактивация, вызванная отравлением катализатора, происходит по разным причинам и в разной степени.
1. Временное отравление (обратимое отравление): Когда яд адсорбируется или химически соединяется с активным центром, образующаяся прочность связи относительно слабая, и можно использовать соответствующие методы для удаления яда, чтобы восстановить активность катализатора без изменения его природы, и такой вид отравления называется обратимым отравлением или временным отравлением.
2. Постоянное отравление (необратимое отравление): Яд взаимодействует с активными компонентами катализатора, образуя очень прочную химическую связь, и яд трудно удалить общим способом, чтобы восстановить активность катализатора; такой вид отравления называется необратимым отравлением или постоянным отравлением.
3. Селективное отравление: После отравления катализатор может потерять каталитическую способность для определенной реакции, но сохранять каталитическую активность для других реакций, это явление называется селективным отравлением. В серии реакций, если яд вызывает отравление только активного участка последующей реакции, реакция может оставаться на средней стадии и получать высокий выход промежуточных продуктов.
4 Проблемы, вызванные отравлением катализатора
4.1 Снижение активности катализатора
1. Захват активных участков: Токсины сильно химически связываются или реагируют с активными участками на поверхности катализатора, в результате чего эти участки оказываются занятыми токсином и препятствуют адсорбции и реакции молекул реагентов, что приводит к значительному снижению активности катализатора. Например, сульфиды (например, H2S) реагируют с поверхностью платиновых или палладиевых катализаторов, образуя сульфид платины или сульфид палладия, что делает эти активные участки бесполезными.
2. Покрытие поверхности: Токсины образуют на поверхности катализатора покрывающий слой, который физически препятствует доступу реактивов к активным участкам катализатора. Этот эффект покрытия также значительно уменьшает эффективную площадь поверхности катализатора и снижает его активность. Например, фосфаты образуют на поверхности некоторых катализаторов покрывающий слой, который препятствует адсорбции реактивов.
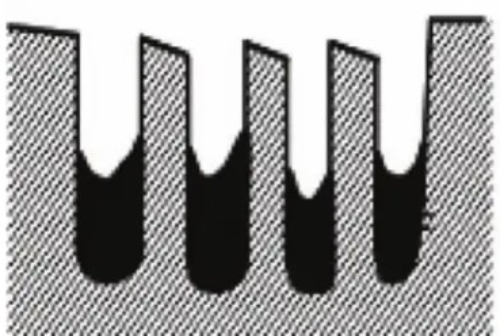
Рис. 7 Структура катализатора, пассивированного после покрытия поверхности
4.2 Селективные изменения
1. Специфическое занятие активных участков
Некоторые токсиканты избирательно связываются с определенными активными участками, что приводит к изменению активности и функции этих участков. Например, некоторые реакции могут зависеть от конкретных типов активных сайтов (например, сайтов, расположенных на определенных кристаллических плоскостях или в конкретных атомных расположениях), и адсорбция токсикантов будет предпочтительно занимать эти сайты, тем самым изменяя общую селективность катализатора.
Например, при селективном гидрировании этилена Pd-катализаторы демонстрируют высокую селективность, но если поверхность катализатора отравлена серой (S), атомы серы будут преимущественно адсорбироваться на активных участках поверхности Pd, изменяя поверхностные свойства катализатора и приводя к реакции, более склонной к образованию нежелательного этана, а не этилена.
2. Изменение пути реакции
Присутствие токсиканта может изменить путь катализируемой реакции, даже если он не полностью занимает активный сайт, путем изменения электронных или геометрических свойств поверхности катализатора, затрудняя образование определенных промежуточных или переходных состояний или повышая вероятность их распада, в результате чего реакция будет направлена на получение другого продукта.
Типичным примером является изменение электронной плотности на поверхности родиевого (Rh) катализатора после отравления катализатора фосфором (P) в реакции гидроформилирования пропилена, что приводит к смещению основного образующегося продукта от н-бутиральдегида к изобутиральдегиду, изменение селективности которого обусловлено различным стабилизирующим действием фосфора на промежуточные продукты реакции.
3. Ремоделирование поверхности и геометрические изменения
Адсорбция токсикантов на поверхности катализатора может привести к перестройке или ремоделированию атомов или молекул на поверхности катализатора, изменяя геометрию поверхности катализатора и тем самым влияя на адсорбцию и реакционные пути молекул реактантов. Такие геометрические изменения могут привести к снижению или полной потере селективности для некоторых специфических реакций.
В реакции синтеза Фишера-Тропша железные (Fe) катализаторы используются для синтеза длинноцепочечных углеводородов. Однако, когда поверхность Fe-катализатора отравляется серой, атомы серы вызывают перестройку поверхности, которая уменьшает образование длинноцепочечных углеводородов и увеличивает образование метана и короткоцепочечных углеводородов. Это изменение селективности связано с изменением геометрической структуры активных участков на поверхности.
Рис. 8 Схематический принцип процесса Фишера-Тропша
4. Изменение стабильности промежуточных продуктов
Присутствие токсикантов может изменить стабильность промежуточных продуктов реакции на поверхности катализатора, что приводит к более легкой десорбции или более сложному образованию определенных промежуточных продуктов, тем самым ограничивая распределение конечного продукта реакции.
В реакции окисления пропилена молибденовый (Mo) катализатор используется для образования акролеина, но если катализатор отравлен хлором (Cl), хлор изменяет стабильность промежуточных продуктов реакции (например, пропиленоксида), что приводит к снижению селективности образования акролеина и увеличению образования неполных продуктов окисления, таких как диоксид углерода.
5. Электронный эффект
Адсорбция токсикантов изменяет электронное окружение на поверхности катализатора, влияя на энергию адсорбции и энергетические барьеры реакции реактантов. Особенно если токсикант сильно электроотрицателен или может образовывать разницу в электронной плотности с поверхностью металла, этот электронный эффект может значительно изменить селективность реакции на катализаторе.
В реакции частичного окисления метанола золотые (Au) катализаторы используются для получения формальдегида, но при наличии кислорода (O2) или оксидов (например, глинозема) адсорбированные атомы кислорода изменяют электронную плотность на поверхности золотых катализаторов, что приводит к дальнейшему окислению формальдегида до муравьиной кислоты или даже углекислого газа, что снижает селективность формальдегида.
4.3 Сокращение срока службы катализатора
Явления отравления часто необратимы, особенно если токсикант сильно реагирует с катализатором, образуя стабильное соединение. Такая необратимая деактивация означает, что катализатор не может быть восстановлен после длительного периода с помощью простых процедур (например, регенерации), что значительно сокращает срок службы катализатора.
Кроме того, действие ядов может привести к изменению структуры поверхности катализатора или даже вызвать агломерацию или спекание частиц катализатора, что еще больше снижает стабильность и срок службы катализатора.
4.4 Увеличение стоимости процесса
Поскольку явление токсикации приводит к снижению активности и срока службы катализатора, процесс требует более частой замены или регенерации катализатора, что увеличивает производственные затраты. Кроме того, перед реакцией может потребоваться сложная предварительная обработка сырья, такая как обессеривание и дефосфоризация, чтобы уменьшить последствия токсикации, что еще больше увеличивает эксплуатационные расходы и инвестиции в оборудование.
5 Меры по борьбе с отравлением катализаторов
5.1 Модификация катализатора
1. Легирование: Легирование - это образование легированных катализаторов с улучшенными свойствами путем соединения драгоценных металлов с другими металлами. Этот метод эффективен для повышения устойчивости катализатора к токсичности. Например, палладий (Pd) сплавляют с другими металлами, такими как золото (Au) или серебро (Ag), чтобы повысить его устойчивость к сернистым и азотистым соединениям.
Сульфиды являются одним из распространенных ядов для катализаторов, особенно в нефтепереработке и химических процессах. Легирование палладия (Pd) золотом (Au) или серебром (Ag) позволяет значительно повысить устойчивость катализатора к сульфидам. Например, катализаторы, легированные палладием и золотом, обладают более высокой устойчивостью к отравлению сульфидами по сравнению с катализаторами из чистого палладия, поскольку присутствие золота изменяет электронную структуру поверхности катализатора и снижает адсорбцию серы, тем самым замедляя скорость отравления.
Нитриды также являются одним из основных источников отравления катализаторов, особенно в реакциях синтеза аммиака и денитрификации. Легирование палладия в сочетании с другими металлами, такими как медь Cu или платина Pt, позволяет повысить устойчивость катализатора к нитридам. Легирование может регулировать электронную плотность и геометрию поверхности катализатора, снижать адсорбционную прочность нитридов и задерживать дезактивацию катализатора.
2. Модификация поверхности: Модификация поверхности катализатора, например, добавление оксидного или углеродного слоя на поверхность катализатора из благородного металла, для предотвращения прямого контакта ядов с активными участками. Например, оксидное покрытие и модификация углеродного слоя.
Добавление оксидного покрытия, такого как оксид алюминия (Al2O3) или диоксид кремния (SiO2), на поверхность катализатора из благородного металла может повысить устойчивость катализатора к токсичности. Например, покрытие из глинозема на поверхности палладиевого катализатора может эффективно блокировать контакт сульфидов с активными участками на поверхности палладия, тем самым повышая сульфидостойкость палладиевого катализатора. Кроме того, оксидное покрытие может обеспечить дополнительные кислотные или основные участки, что еще больше повышает селективность и активность катализатора.
Добавление углеродного слоя на поверхность катализатора из драгоценного металла также является эффективным методом модификации поверхности. Углеродный слой может предотвратить прямой контакт токсикантов с активными участками катализатора за счет адсорбции и экранирования. Например, нанесение слоя графена или активированного угля на поверхность палладиевого катализатора позволяет повысить его устойчивость к сульфидам и нитридам, сохраняя при этом хорошую каталитическую активность. Модификация углеродного слоя не только повышает устойчивость катализатора к токсичным веществам, но и улучшает его термическую стабильность и механическую прочность.
5.2 Предварительная обработка сырья
Предварительная обработка сырья - ключевой шаг в предотвращении отравления катализатора драгоценными металлами. Благодаря эффективному обессериванию, дефосфоризации и денитрогенизации можно значительно снизить воздействие яда на катализатор, продлить срок службы катализатора и сохранить его эффективную каталитическую работу.
1. Десульфуризация: Десульфуризация означает удаление сульфидов из исходного сырья перед реакцией для предотвращения отравления катализатора сульфидами. Сульфиды являются одним из распространенных ядов катализатора, особенно в нефтепереработке и химическом производстве, где они реагируют с активными участками на поверхности катализатора, что приводит к его деактивации. Гидродесульфуризация - это распространенная технология сероочистки, которая удаляет сероводород из сырья путем реакции с сульфидом при высокой температуре и высоком давлении с использованием гидрогенизированного газа, содержащего водород, для преобразования сульфида в сероводород (H₂S). Этот метод эффективно удаляет из сырья сероорганические соединения, такие как меркаптаны, тиоэфиры и тиоэфиры, тем самым снижая токсическое воздействие этих сульфидов на катализатор.
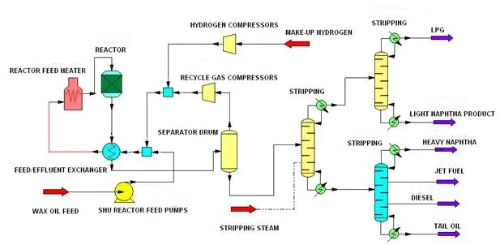
Рис. 9 Процесс гидродесульфуризации
2. Дефосфоризация: фосфид также является одним из основных источников отравления катализатора, особенно в некоторых каталитических реакциях, фосфид вступает в реакцию с поверхностью катализатора, что приводит к разрушению активного участка. Поэтому очень важно использовать дефосфорирующий агент для дефосфоризации сырья. Дефосфорирующий агент - это химический реагент, специально разработанный для удаления фосфида из сырья. Дефосфорирующий агент вступает в реакцию с фосфидами в сырье, образуя твердый осадок, нерастворимый в сырье, и таким образом удаляет их. Например, в некоторых промышленных процессах дефосфорирующие агенты на основе кальция могут использоваться для реакции с фосфатами с образованием осадка фосфата кальция, что позволяет достичь цели дефосфоризации.
3. Денитрогенизация: Азотсодержащие соединения также являются одной из важных причин отравления катализаторов, особенно в реакциях нефтехимии и органического синтеза, где соединения азота соединяются с активными участками катализатора, что приводит к его деактивации. Чтобы избежать этого, необходимо проводить денитрификацию сырья. Азотсодержащие соединения также являются одной из важных причин отравления катализаторов, особенно в реакциях нефтехимии и органического синтеза, где нитриды соединяются с активными участками катализатора, что приводит к его дезактивации. Чтобы избежать такой ситуации, необходимо проводить денитрификацию сырья.
5.3 Оптимизация условий реакции
1. Контролируйте температуру реакции: температура реакции оказывает непосредственное влияние на активность и стабильность катализатора. Адсорбция и десорбция реактантов и промежуточных продуктов, а также скорость образования ядов будут меняться при различных температурных условиях. Оптимизируя температуру реакции, можно уменьшить образование и адсорбцию токсичных веществ. Проведение реакции при более низких температурах снижает образование некоторых токсичных побочных продуктов. Многие токсичные вещества (например, сульфиды, фосфиды) легче образуются при более высоких температурах, и понижение температуры реакции может препятствовать образованию этих побочных продуктов. Например, в процессе гидродесульфуризации (HDS) образование сероводорода (H₂S) может быть снижено путем понижения температуры реакции, что защищает катализатор от отравления сульфидами. Низкие температуры помогают уменьшить адсорбцию ядов на поверхности катализатора. Высокие температуры увеличивают кинетическую энергию реактивов и ядов, облегчая их сильную хемосорбцию с активными участками на поверхности катализатора, что может привести к отравлению катализатора. Контролируя температуру реакции, можно уменьшить адсорбцию ядов и продлить активный цикл катализатора.
2. Контролируйте давление водорода: в реакции гидрирования давление водорода является ключевым параметром, который напрямую влияет на скорость реакции и селективность катализатора. Оптимизируя давление водорода, можно эффективно уменьшить чрезмерное гидрирование и образование ядов, тем самым защищая катализатор из драгоценных металлов от отравления. В реакциях гидрирования слишком высокое давление водорода может привести к чрезмерному гидрированию реактантов и образованию нежелательных полностью гидрированных продуктов. Например, в реакции частичного гидрирования алкинов слишком высокое давление водорода может привести к чрезмерному гидрированию алкинов до алканов вместо целевого продукта - олефинов. Контролируя давление водорода, можно точно регулировать степень гидрирования реактантов, чтобы избежать избыточного гидрирования, тем самым улучшая селективность реакции и защищая активность катализатора. Давление водорода также влияет на образование ядов. В некоторых реакциях избыточное давление водорода может способствовать возникновению побочных реакций и образованию токсичных побочных продуктов. Например, при частичном окислении метана избыточное давление водорода может привести к дальнейшему окислению формальдегида до муравьиной кислоты или диоксида углерода, тем самым увеличивая токсичность ядов для катализатора. Оптимизируя давление водорода, можно подавить возникновение этих побочных реакций, уменьшить образование ядов и защитить активность катализатора.
5.4 Регенерация катализатора
Регенерация катализатора является важной частью процесса предотвращения отравления катализаторов из драгоценных металлов. В процессе использования катализаторы неизбежно загрязняются ядами, что приводит к снижению каталитической активности. С помощью соответствующих методов регенерации яды на поверхности катализатора можно удалить и восстановить его каталитическую эффективность.

Рис. 10 Сравнение внешнего вида различных катализаторов до и после регенерации
1. Химическая регенерация: Удаление ядов на поверхности катализатора химическими методами, такими как окислительная или восстановительная обработка. Этот метод обычно включает окислительную обработку и восстановительную обработку.
Окислительная обработка удаляет токсичные вещества на поверхности катализатора путем введения кислорода или других окислительных агентов для окисления и разложения органических токсичных веществ или других окисляемых веществ на поверхности катализатора. Например, в катализатор, загрязненный углеводородами, можно ввести воздух или кислород при высокой температуре, чтобы окислить углеводороды на поверхности до диоксида углерода и воды, тем самым удалив яды.
Восстановительная обработка катализаторов, загрязненных восстановительными ядами, осуществляется путем введения восстановителя, например водорода, для восстановления их активности. Например, палладиевый катализатор, отравленный сульфидом, можно подвергнуть восстановительной обработке в атмосфере водорода, чтобы превратить сульфид палладия на поверхности в металлический палладий и сероводородный газ, тем самым удалив яд и восстановив активность катализатора.
2. Термическая обработка Регенерация: Удаление органических ядов или коксовых отложений на поверхности катализатора путем высокотемпературного обжига для восстановления активности катализатора. Этот метод включает в себя обжиг и пиролиз.
Высокотемпературный обжиг заключается в обработке катализатора при высоких температурах для удаления органических ядов или углеродных отложений на поверхности путем термического разложения или сжигания. Например, для катализатора, отравленного коксовыми отложениями, катализатор можно обработать путем обжига при высокой температуре, чтобы сжечь кокс на поверхности, тем самым удалив яды и восстановив активность катализатора. Температура и время обжига должны быть оптимизированы в зависимости от природы катализатора и типа яда, чтобы обеспечить эффективное удаление яда без повреждения структуры катализатора.
Пиролизная обработка удаляет яды путем разложения органических ядов на поверхности катализатора на летучие продукты при высоких температурах. Например, для катализаторов, отравленных фосфорорганическими соединениями, обработка пиролизом может проводиться при высоких температурах для разложения фосфидов на газообразные продукты, что позволяет удалить яды и восстановить активность катализатора.
5.5 Использование селективных ингибиторов токсичности
Добавление сокатализаторов в реакционную систему также может быть эффективным для защиты катализаторов из драгоценных металлов. Например, добавление небольшого количества оксидов металлов может адсорбировать или преобразовывать токсичные вещества, тем самым защищая активность катализатора. В системах палладиевых катализаторов добавление небольших количеств оксидов лантана (La) или церия (Ce) может значительно повысить серостойкость катализатора. Оксиды этих металлов вступают в реакцию с токсикантами и не дают им связываться с катализатором из драгоценных металлов, тем самым продлевая срок службы катализатора и сохраняя его эффективность.
5.6 Усовершенствованные конструкции катализаторов
1. Катализаторы с ядром-оболочкой: Катализаторы с оболочкой представляют собой катализатор, в котором активное металлическое ядро заключено в стабильный слой оболочки. Катализатор с оболочкой состоит из ядра (активный металл) и оболочки (защитный слой). Оболочка обычно изготавливается из стабильного материала с хорошей токсичностью, такого как мезопористые оксиды кремния, углеродные материалы или глинозем. Материал оболочки позволяет реактивам достигать активных участков ядра за счет создания пор и каналов подходящего размера, блокируя при этом проникновение макромолекулярных ядов. Такая структура позволяет активному металлическому ядру проходить только через микропоры или наноканалы, когда оно вступает в контакт с реактивами, тем самым эффективно предотвращая прямой контакт ядов и их адсорбцию на поверхности активного металла. В случае палладия (Pd), например, катализаторы, в которых палладиевое ядро заключено в мезопористый оксид кремния (SiO2), могут быть значительно более устойчивы к токсикации. В такой структуре палладиевое ядро обеспечивает эффективную каталитическую активность, а слой мезопористой оболочкиSiO2, благодаря своей селективности по размеру пор, позволяет реактивам с малыми молекулами проникать в палладиевое ядро и реагировать с ним, блокируя при этом яды с большими молекулами, тем самым эффективно предотвращая отравление палладиевым ядром.
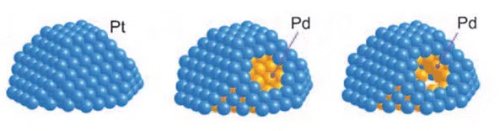
Рис. 11. Структура катализатора Pt-Pd Core-Shell
2. Моноатомные катализаторы: Моноатомные катализаторы изготавливаются путем высокого диспергирования атомов активного металла на поверхности носителя таким образом, чтобы каждый активный участок состоял из одного атома. Такая высокодисперсная структура позволяет максимально использовать атомы металла и значительно повышает активность и селективность катализатора. В то же время, поскольку каждый атом металла существует независимо, ядам трудно скапливаться на его поверхности, что снижает риск отравления катализатора. Например, одноатомные палладиевые катализаторы могут быть высокодисперсными на углеродных носителях, легированных азотом. Каждый атом палладия стабилизируется на легированных азотом участках за счет сильных взаимодействий, и такая конструкция не только усиливает каталитическую активность, но и значительно повышает устойчивость катализатора к ядам. Поскольку ядам трудно объединиться вокруг отдельных атомов палладия, катализатор значительно более устойчив к токсическому воздействию.
5.7 Экологичные каталитические процессы
Для снижения проблемы токсичности традиционных катализаторов можно предпринять следующие конкретные меры. Во-первых, используйте экологически чистые растворители, такие как вода или сверхкритическийCO ₂, вместо токсичных органических растворителей, чтобы уменьшить отравляющее действие ядов на катализатор. Это не только повышает безопасность реакции, но и снижает загрязнение окружающей среды. Во-вторых, разрабатываются новые каталитические системы, такие как исследование и разработка новых технологий, например, ферментного катализа или фотокатализа. Ферментный катализ позволяет осуществлять "зеленые" химические реакции благодаря высокой селективности и эффективности биологических ферментов, а фотокатализ использует световую энергию для управления процессом реакции и позволяет избежать проблемы отравления, характерной для традиционных катализаторов. Эти инновационные подходы не только повышают эффективность реакции, но и снижают негативное воздействие на окружающую среду и здоровье людей.
6 Заключение
Катализаторы на основе драгоценных металлов играют незаменимую роль в химической промышленности, преобразовании энергии и защите окружающей среды благодаря своим эффективным каталитическим свойствам и широкому спектру применения. Однако токсичность катализаторов существенно ограничивает их долгосрочную стабильную работу и эффект от применения. Благодаря глубокому изучению механизма работы катализаторов из драгоценных металлов и причин отравления мы можем принять различные меры для повышения способности катализаторов к отравлению и срока их службы.
Во-первых, модификация катализатора, такая как легирование и модификация поверхности, может значительно повысить эффективность катализаторов против отравления. Во-вторых, предварительная обработка сырья и оптимизация условий реакции могут эффективно снизить образование и адсорбцию токсичных веществ. Кроме того, регенерация катализатора и использование селективных ингибиторов токсикантов могут помочь восстановить и поддержать активность катализатора. Усовершенствованные конструкции катализаторов, такие как структурированные катализаторы с ядрами-оболочками и одноатомные катализаторы, открывают новые пути для борьбы с отравлениями. Наконец, применение "зеленых" каталитических процессов не только способствует снижению токсичности, но и содействует процессу устойчивого развития.
В заключение следует отметить, что производительность и срок службы катализаторов на основе драгоценных металлов могут быть значительно увеличены за счет совместного применения этих стратегий, что позволит удовлетворить спрос на эффективные, стабильные и экологически безопасные катализаторы в промышленном производстве. Будущие исследования должны быть посвящены разработке новых катализаторов против отравления и зеленых каталитических технологий для дальнейшего содействия широкому применению катализаторов на основе драгоценных металлов в различных областях.
Похожие статьи:
Применение катализаторов из драгоценных металлов: Порошок против гранул
Ссылки:
[1] Qin T, Li N, Ma H, et al. Влияние металлов VIII группы на пиролиз бурого угля и газификацию древесного угля с помощью катализатора на основе Ca[J]. Fuel, 2024, 372.
[2] Lysne A, Saxrud I, Snidaro L R, et al. Промотированные благородными металлами (Pt, Pd и Rh) Ni-Co/Mg (Al)O катализаторы для парового риформинга смолистых примесей из газификации биомассы[J]. Journal of Catalysis, 2024, 436.
[3] Nejadmoghadam E, Achour A, Öhrman O, et al. Stabilization of fresh and aged simulated pyrolysis oil through mild hydrotreatment using noble metal catalysts[J]. Energy Conversion and Management, 2024, 313.
[4] Li L, Chen T, Zhang L, et al. Недавний прогресс наноматериалов на основе Ni в качестве промотора для повышения эффективности реакции выделения водорода на катализаторах из благородных металлов[J]. Journal of Alloys and Compounds, 2024, 998.
[5] Yun W, Rui Y, Qiang Z, et al. Нанокристаллы La-RuO2 с эффективной электрокаталитической активностью для общего расщепления воды в кислых средах: Синергетический эффект легирования La и кислородных вакансий[J]. Chemical Engineering Journal, 2022, 439.

 Бары
Бары
 Бисер и шары
Бисер и шары
 Болты и гайки
Болты и гайки
 Кристаллы
Кристаллы
 Диски
Диски
 Волокна и ткани
Волокна и ткани
 Фильмы
Фильмы
 Хлопья
Хлопья
 Пены
Пены
 Фольга
Фольга
 Гранулы
Гранулы
 Медовые соты
Медовые соты
 Чернила
Чернила
 Ламинат
Ламинат
 Шишки
Шишки
 Сетки
Сетки
 Металлизированная пленка
Металлизированная пленка
 Тарелка
Тарелка
 Порошки
Порошки
 Род
Род
 Простыни
Простыни
 Одиночные кристаллы
Одиночные кристаллы
 Мишень для напыления
Мишень для напыления
 Трубки
Трубки
 Стиральная машина
Стиральная машина
 Провода
Провода
 Конвертеры и калькуляторы
Конвертеры и калькуляторы
 Пишите для нас
Пишите для нас
 Chin Trento
Chin Trento



