Все, что нужно знать об оксидах титана
Введение
Оксиды титана - это соединения, состоящие из титана и кислорода, известные своими замечательными свойствами и широким спектром применения. Эти оксиды представлены в основном двумя формами: диоксидом титана (TiO₂) и монооксидом титана (TiO). В этой статье мы рассмотрим характеристики, методы синтеза, области применения и влияние оксидов титана на окружающую среду.
Виды оксидов титана
1. Диоксид титана (TiO₂)
TiO₂ - это белый порошок без запаха с высоким коэффициентом преломления и сильным поглощением ультрафиолетового света. Он обладает фотокаталитической активностью и химической стабильностью, а также нетоксичен.
TiO₂ существует в трех основных полиморфах- анатазе, рутиле и бруките. Наиболее распространены анатаз и рутил, причем рутил термодинамически стабилен, а анатаз превращается в рутил при нагревании.

2. Монооксид титана (TiO)
TiO менее распространен, обладает металлическим блеском и электропроводностью. Он имеет структуру каменной соли и часто используется в специализированных областях, таких как тонкие пленки и покрытия.
Синтез оксидов титана
1. Диоксид титана (TiO₂)
- Сульфатный процесс получения TiO₂ включает в себя реакцию ильменита (FeTiO₃) с серной кислотой, в результате которой образуется титанилсульфат. Это соединение затем гидролизуют и прокаливают, чтобы получить диоксид титана.
- Другой метод, известный как хлоридный процесс, включает хлорирование ильменита или рутила при высоких температурах с образованием тетрахлорида титана (TiCl₄), который впоследствии окисляется с получением TiO₂.
- Более современный подход - золь-гель метод, при котором алкоксиды титана подвергаются гидролизу и полимеризации с последующей сушкой и прокаливанием. В результате этого процесса получаются наночастицы TiO₂ с контролируемым размером и морфологией.
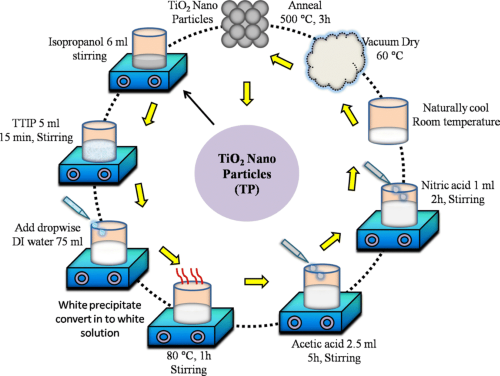 [1]
[1]
2. Монооксид титана (TiO)
При синтезе монооксида титана (TiO) обычно используются восстановительные методы. Обычно TiO получают путем восстановления TiO₂ водородом или путем прямого соединения титана и кислорода в тщательно контролируемых условиях.
Области применения оксидов титана
1. Диоксид титана (TiO₂)
- Пигменты: TiO₂ является наиболее широко используемым белым пигментом благодаря своей яркости и непрозрачности. Он используется в красках, покрытиях, пластмассах, бумаге и чернилах.
- Солнцезащитные средства и косметика: Благодаря сильному поглощению ультрафиолетовых лучей TiO₂ является ключевым ингредиентом солнцезащитных кремов и других косметических средств, обеспечивая защиту от вредного ультрафиолетового излучения.
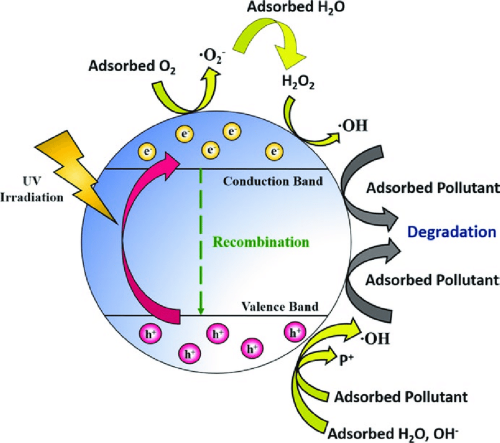
- Фотокатализ: Фотокаталитические свойстваTiO₂делают его полезным в экологических приложениях, таких как очистка воздуха и воды, самоочищающиеся поверхности и антибактериальные покрытия.
- Электроника: TiO₂ используется в производстве электронных компонентов, таких как варисторы и конденсаторы, благодаря своим диэлектрическим свойствам.
 [2]
[2]
2. Монооксид титана (TiO)
Тонкие пленки и покрытия: TiO используется в производстве тонких пленок для применения в оптических покрытиях, полупроводниках и датчиках. Его электропроводность и термическая стабильность делают его подходящим для этих целей.
Воздействие на окружающую среду и безопасность
Воздействие на окружающую среду: Хотя TiO₂ в целом считается безопасным для здоровья человека и окружающей среды, его широкое использование вызывает опасения по поводу загрязнения окружающей среды наночастицами. Наночастицы TiO₂ могут попадать в водоемы, потенциально влияя на жизнь водных организмов. Поэтому существуют правила и рекомендации, регулирующие их производство и утилизацию.
Здоровье человека: TiO₂ считается нетоксичным, и его использование в продуктах питания, косметике и фармацевтических препаратах регулируется для обеспечения безопасности. Однако вдыхание пыли TiO₂ может представлять опасность для дыхательных путей, что подчеркивает важность правильного обращения и защитных мер в промышленных условиях.
Фотокаталитическая активность: Фотокаталитические свойства TiO₂ могут приводить к образованию реактивных видов кислорода (ROS), которые могут оказывать как благоприятное, так и вредное воздействие. В экологических приложениях ROS могут разлагать загрязняющие вещества, но чрезмерное воздействие ROS может вызвать окислительный стресс в живых организмах.
Перспективы на будущее и исследования
В настоящее время ведутся исследования по разработке усовершенствованных материалов на основе TiO₂ с улучшенными свойствами для применения в накопителях энергии, фотовольтаике и фотокатализе. Инновации включают легирование TiO₂ другими элементами для повышения его эффективности и изучение новых методов синтеза для лучшего контроля над размером и морфологией частиц.
Предпринимаются усилия по разработке более устойчивых и экологически безопасных методов производства и использования оксидов титана. Это включает в себя использование принципов "зеленой химии", переработку отходов TiO₂ и повышение эффективности фотокаталитических процессов.
Заключение
Оксиды титана, в частности TiO и TiO₂, играют важнейшую роль в различных отраслях промышленности. TiO, обладающий металлическим блеском и электропроводностью, в основном используется в таких специализированных областях, как производство тонких пленок и покрытий. В то время как TiO₂, известный своим высоким коэффициентом преломления, сильным поглощением ультрафиолетового света, фотокаталитической активностью и химической стабильностью, находит широкое применение в пигментах, солнцезащитных средствах, косметике, фотокатализе и электронике.
По мере развития технологий оксиды титана будут оставаться на переднем крае материаловедения и промышленного применения. Stanford Advanced Materials (SAM) предлагает высококачественную титановую продукцию по конкурентоспособным ценам. Мы предлагаем фотокаталитический порошок нанодиоксида титана, порошок нанодиоксида титана для литиевых батарей, порошок нанодиоксида титана для керамики, а также анатазную и рутиловую формы диоксида титана. Для получения дополнительной информации, пожалуйста, посетите нашу домашнюю страницу.
|
Аспект |
Монооксид титана (TiO) |
|
|
Свойства |
Белый порошок без запаха, высокий коэффициент преломления, сильное поглощение ультрафиолетового света, фотокаталитическая активность, химическая стабильность, нетоксичен. |
Металлический блеск, электропроводность, структура каменной соли. |
|
Методы синтеза |
Сульфатный процесс: Реакция ильменита (FeTiO₃) с серной кислотой, гидролиз и прокаливание титанилсульфата для получения TiO₂. Хлоридный процесс: Хлорирование ильменита или рутила с образованием TiCl₄, затем окисление с получением TiO₂. Метод золь-гель: Гидролиз и полимеризация алкоксидов титана с последующей сушкой и прокаливанием для получения наночастицTiO ₂. |
Методы восстановления: ВосстановлениеTiO₂ водородом или прямым соединением титана с кислородом в контролируемых условиях. |
|
Области применения |
Пигменты: Краски, покрытия, пластмассы, бумага и чернила. Солнцезащитные средства и косметика: Защита от ультрафиолетового излучения. Фотокатализ: Очистка воздуха и воды, самоочищающиеся поверхности, антибактериальные покрытия. Электроника: Варисторы, конденсаторы. |
Тонкие пленки и покрытия: Оптические покрытия, полупроводники, сенсоры. |
Ссылки:
[1] Pawar, Vani & Kumar, Manish & Dubey, Pawan & Singh, Manish Kumar & Sinha, Ask & Singh, Prabhakar. (2019). Влияние маршрута синтеза на структурные, оптические и электрические свойства TiO2. Прикладная физика A. 125. 10.1007/s00339-019-2948-3.
[2] Leong, Kah & Ching, Sim & Pichiah, Saravanan & Ibrahim, S. (2016). Наноматериалы, управляемые светом, для удаления сельскохозяйственных токсинов.

 Бары
Бары
 Бисер и шары
Бисер и шары
 Болты и гайки
Болты и гайки
 Кристаллы
Кристаллы
 Диски
Диски
 Волокна и ткани
Волокна и ткани
 Фильмы
Фильмы
 Хлопья
Хлопья
 Пены
Пены
 Фольга
Фольга
 Гранулы
Гранулы
 Медовые соты
Медовые соты
 Чернила
Чернила
 Ламинат
Ламинат
 Шишки
Шишки
 Сетки
Сетки
 Металлизированная пленка
Металлизированная пленка
 Тарелка
Тарелка
 Порошки
Порошки
 Род
Род
 Простыни
Простыни
 Одиночные кристаллы
Одиночные кристаллы
 Мишень для напыления
Мишень для напыления
 Трубки
Трубки
 Стиральная машина
Стиральная машина
 Провода
Провода
 Конвертеры и калькуляторы
Конвертеры и калькуляторы
 Chin Trento
Chin Trento


